
こんにちは、ヘルメット犬(@helmet_dog)です。
この記事では
- 酸化還元電位とは
- ネルンストの式
について公害防止管理者試験で問われやすい部分を中心にサクッと整理します!
酸化還元電位とは
酸化、還元とは
酸化:ある原子や化合物から電子が失われること。
還元:ある原子や化合物から電子を得ること。
であり、電子のやり取りを意味します。
そして、酸化させる物質、還元させる物質をそれぞれ酸化剤、還元剤と言います。
酸化剤:原子や化合物からから電子を奪い取り、酸化させる物質。自らは還元される。
還元剤:原子や化合物に電子を与え、還元させる物質。自らは酸化される。
廃液処理では適切な処理をするため、溶液が酸化しやすい状態なのか、還元しやすい状態なのかを把握する必要があります。
そこで、指標となるのが酸化還元電位です。
酸化還元電位は
電子の放出しやすさや受け取りやすさを定量的に表したもの
すなわち、酸化が起きやすい状態か、還元が起きやすい状態かの指標
になります。酸化還元電位はORP(=Oxidation-Reduction Potential)ともいわれます。
ネルンストの式
ネルンストの式は酸化還元電位を表す式で以下で表されます。
式の形は試験でも問われるので覚えておきたいですね。
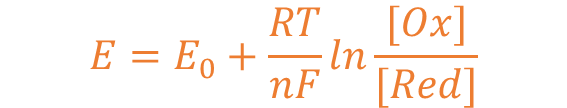
| E | 酸化還元電位 | E0 | 標準酸化還元電位 |
| R | 気体定数 | T | 絶対温度 |
| n | 移動する電子のモル数 | F | ファラデー定数 |
| [Ox] | 酸化剤濃度 | [Red] | 還元剤濃度 |
このうちE0は[Ox]=[Red]、つまり酸化剤濃度と還元剤濃度が同じ時の酸化還元電位を表し、標準酸化還元電位と言います。
E0が高い系は低い系を酸化することができます。
よってE0が高いものほど強い酸化剤で、低いものほど強い還元剤と言えます。
標準酸化還元電位の具体例を示します。
- オゾン
O3 + 2H+ + 2e– ⇄ O2 + H2O 標準酸化還元電位E0 = 2.07V - 塩素
Cl2 + 2e– ⇄ 2Cl– 標準酸化還元電位E0 = 1.36V - 酸素
O2 + 4H+ + 4e– ⇄ 2H2O (酸性) 標準酸化還元電位E0 = 1.23V - 鉄イオン(Ⅲ)
Fe3+ + e– ⇄ Fe2+ 標準酸化還元電位E0 = 0.75V - 水素イオン
2H+ + 2e– ⇄ H2 標準酸化還元電位E0 = 0V (水素が基準となっている) - 鉄イオン(Ⅱ)
Fe2+ + 2e– ⇄ Fe 標準酸化還元電位E0 = -0.44V
参考
- 新・公害防止の技術と法規 汚水処理特論、水質有害物質特論
- JEMIMA pH 計測器及びORP 計測器
- MST ORP(酸化還元電位)について



コメント
夜分遅くに失礼いたします。
令和3年度の公害防止管理者(水質1種)を受験を志している者です。
これ以上ないくらいに分かりやすく、素晴らしいブログ記事に出会えたことに感激し、コメントさせていただきました。
色々とお仕事の都合などもあるかと思いますので、まずはお体を大事に、気分がのった時などで構いませんので、ブログが更新されることを心待ちにしています。
何卒よろしくお願いします。
ご返事遅くなり申し訳ありません。
ありがたいお言葉ありがとうございます。
最近はなかなか時間を割くことができておりませんが、気長に待っていただけると幸いです。
水質一種の試験はなかなかボリュームがあり、勉強も大変かと存じますが、応援しております。